阅读: 14 发表于 2024-06-24 23:32

肾素-血管紧张素-醛固酮系统(RAAS)在维护心血管、肾脏、脑等脏器的正常功能及调节血压均有重要作用。RAAS成分复杂,欧博官网可以将其分为经典途径和非经典途径,经典途径包括ACE–Ang II–AT1轴,非经典途径包括ACE2/Ang1-7/MAS1轴及AngIV/IRAP轴。以RAAS为靶点的药物除经典的ACEI、ARB等药物之外,还有很多其他的药物正在研发之中。
01
RAAS经典途径
肝脏合成的血管紧张素原在肾小球旁器分泌的肾素的作用下生成血管紧张素I(AngI),AngI在血管紧张素转化酶(ACE)的作用下生成血管紧张素II(AngII)。AngII是RAAS的最重要的活性物质,它的经典的作用主要是通过作用于AngII 1型受体(AT1)而介导的,此途径称为ACE–Ang II–AT1轴。人体大部分组织均有AT1表达,它的激活可导致血管收缩、水钠重吸收、纤维化及炎症反应等等。肾上腺中的AT1受体激活可促进醛固酮生成,后者与盐皮质激素受体结合,欧博促进钠的重吸收和增加钾的排出。
除激活AT1,AngII还可激活AngII 2型受体(AT2)。相比于AT1,AT2在组织中表达较少,但是在损伤的情况下表达上调。AT2激活可起到抗增生、抗纤维化、抗炎症、促凋亡及舒张血管等作用,对机体具有保护意义。
02
RAAS非经典途径
RAAS非经典途径由酶、肽及受体组成,包括血管紧张素转换酶2(ACE2)、血管紧张素1-7(Ang-(1-7))、血管紧张素IV (Ang IV) 、MAS1及胰岛素调节的氨基肽酶(IRAP)。这些成分涉及到RAAS非经典途径的两条轴:ACE2/Ang1-7/MAS1 轴 及AngIV/IRAP 轴。
ACE2/Ang1-7/MAS1 轴被认为与ACE–Ang II–AT1 轴起对抗作用,两者相互制衡,维护机体稳态。ACE2可裂解AngⅡ直接生成Ang-(1-7),这是Ang-(1-7)生成的主要途径。ACE2亦可将AngI转化为Ang-(1-9),欧博娱乐后者再经ACE转化为Ang-(1-7)。Ang-(1-7)结合G蛋白偶联受体MAS1, 从而发挥抗纤维化、抗炎、抑制血管平滑肌增生、促进一氧化氮释放、舒张血管等作用。
展开全文
AngIV/IRAP 轴即AngIV/AT4受体系统,AT4后被鉴定是胰岛素调节的氨基肽酶(IRAP)。IRAP是AngIV的特异性高亲和力受体,位于葡萄糖转运蛋白GLUT-4的储存囊泡上,具有降解血管加压素及催产素的作用。Ang IV抑制IRAP酶活性,从而发挥抗纤维化、抗炎、促进NO释放及改善记忆和学习功能的作用。
03
经典的干预RAAS药物
经典的RAAS拮抗剂包括血管紧张素转换酶抑制剂(ACEI,如贝那普利、卡托普利、依那普利、赖诺普利等),血管紧张素受体拮抗剂 (ARBs,如缬沙坦、氯沙坦、厄贝沙坦等), 盐皮质激素受体拮抗剂(MRA, 螺内酯,欧博allbet依普利酮,坎利酮)及直接肾素抑制剂(阿利吉仑)。
04
新型RAAS激动剂及阻断剂
1
针对ACE–Ang II–AT1轴的药物
血管紧张素受体-脑啡肽酶抑制剂(ARNI): 沙库巴曲缬沙坦(LCZ696)是首个ARNI,由脑啡肽酶抑制剂沙库巴曲和ARB缬沙坦以l:l摩尔比例组合而成,具有利尿、利钠、舒张血管、抑制心室重构甚至逆转心肌肥厚等作用。CFDA已批准其用于治疗射血分数降低的慢性心力衰竭成人患者。
非甾体类盐皮质激素受体拮抗剂: 作为新一代的醛固酮受体拮抗剂,finerenone的基础研究和临床研究显示出较优的安全性和有效性, 在降低高钾血症和肾功能损伤方面具有独特的优势。
醛固酮合酶抑制剂: 醛固酮生物合成过程中的关键酶为醛固酮合酶 (CYP11B2), 开发选择性的CYP11B2抑制剂是当前研究的热点。FAD286A, LCI699是目前正在研发的两个醛固酮合酶抑制剂。动物实验显示FAD286A能降低醛固酮、降低血压及改善心脏和肾脏损伤。LCI699已经进入临床试验阶段,对库欣综合征的II期临床试验显示LCI699可降低尿游离皮质醇。
AT2激动剂: Compound 21是AT2的激动剂,动物研究显示Compound 21可降低蛋白尿、抗纤维化、改善心脏功能。但是目前未见临床研究发表。
2
针对ACE2– Ang-(1-7)–MAS1 轴的药物
人重组ACE2 (rhACE2): 动物研究显示rhACE2可延缓糖尿病肾病紧张,降低血压、减轻急性肺损伤及延缓心脏纤维化。 人体研究表明rhACE2可以减少Ang II及增加Ang-(1-7),且是安全的。 可惜的是,rhACE2在急性肺损伤中的II临床试验显示rhACE2未能明显改善急性肺损伤患者短期的生理情况及临床结局。
MAS1激动剂: 非肽类复合物AVE0991可与Ang-(1-7)竞争性结合MAS1。 动物实验表明AVE 0991具有降血压、减轻肾脏炎症。 但是目前,AVE 0991未进行临床试验。 此外,研发能使Ang-(1-7)免受酶降解的复合物已成为热点。 将Ang-(1-7)与羟丙基β-环糊精的结合可防止Ang-(1-7)降解。 该药物组合已在高血压动物模型显示出降压作用,并且在糖尿病和动脉粥样硬化炎症模型中也具有有益作用。 目前正在进行I期临床试验检测其安全性。
IRAP抑制剂: 目前已经研发出一组IRAP的非肽类抑制剂。 HFI 419是IRAP选择性吡啶基复合物,可增强大鼠的记忆力,具有抗炎特性。 HFI419可防止Ang II诱发的心脏和内皮损伤,且作用不依赖于血压。 此外,基于IRAP与GLUT4的关联性,科学家们对IRAP抑制剂是否可用于改善胰岛素敏感性产生了极大的兴趣。 目前仍需要更多研究探讨IRAP抑制剂的治疗价值。
3
针对RAAS的疫苗
以往试图研发针对肾素、Ang I、Ang II和AT1的疫苗,但发现它们存在安全性问题或是临床疗效不佳。如抗Ang II的疫苗的IIa期临床试验虽显示其是安全的且能降低血压,但进一步的研究无法确认这些结果。目前正在应用新型的策略研发针对RAAS的疫苗,例如在甲型肝炎病毒样颗粒表面嵌入Ang II形成嵌合蛋白以刺激AngII特异性抗体的产生。
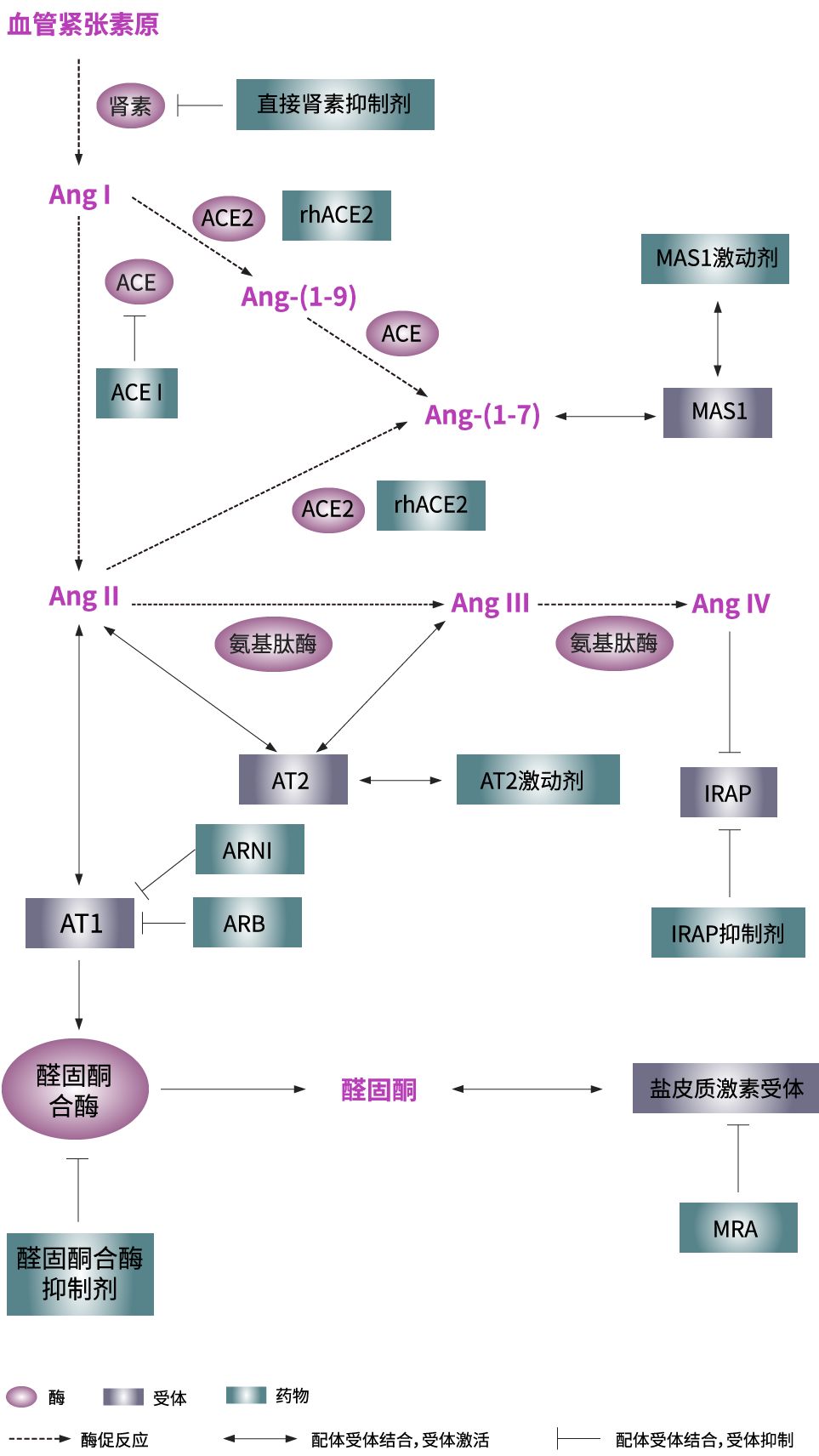
RAAS组成及主要的激动剂及抑制剂
AngI,血管紧张素I;AngII,血管紧张素II;AT1,AngII 1型受体;AT2,AngII 2型受体;ACE2,血管紧张素转化酶2;Ang-(1-7),血管紧张素1-7;Ang-(1-9),血管紧张素1-9;IRAP,胰岛素调节的氨基肽酶;Ang III, 血管紧张素III;Ang IV,血管紧张素IV;ACEI,血管紧张素转化酶抑制剂;ARB,血管紧张素受体拮抗剂;ARNI,血管紧张素受体-脑啡肽酶抑制剂;rhACE2,人重组ACE2; MRA, 盐皮质激素受体拮抗剂
综上,针对经典途径中的靶点(AT2、醛固酮合酶、盐皮质激素受体、血管紧张素II等)以及非经典途径中的靶点(ACE2, MAS1,IRAP等)的药物未来有希望被应用于临床。
参考文献:
1. Arendse LB, Danser AHJ, Poglitsch M, et al. Novel Therapeutic Approaches Targeting the Renin-Angiotensin System and Associated Peptides in Hypertension and Heart Failure. Pharmacol Rev 2019; 71(4): 539-570.
2. Romero CA, Orias M, Weir MR. Novel RAAS agonists and antagonists: clinical applications and controversies. Nat Rev Endocrinol 2015; 11(4): 242-252.
3. Mascolo A, Sessa M, Scavone C, et al. New and old roles of the peripheral and brain renin-angiotensin-aldosterone system (RAAS): Focus on cardiovascular and neurological diseases. Int J Cardiol 2017; 227: 734-742.返回搜狐,查看更多